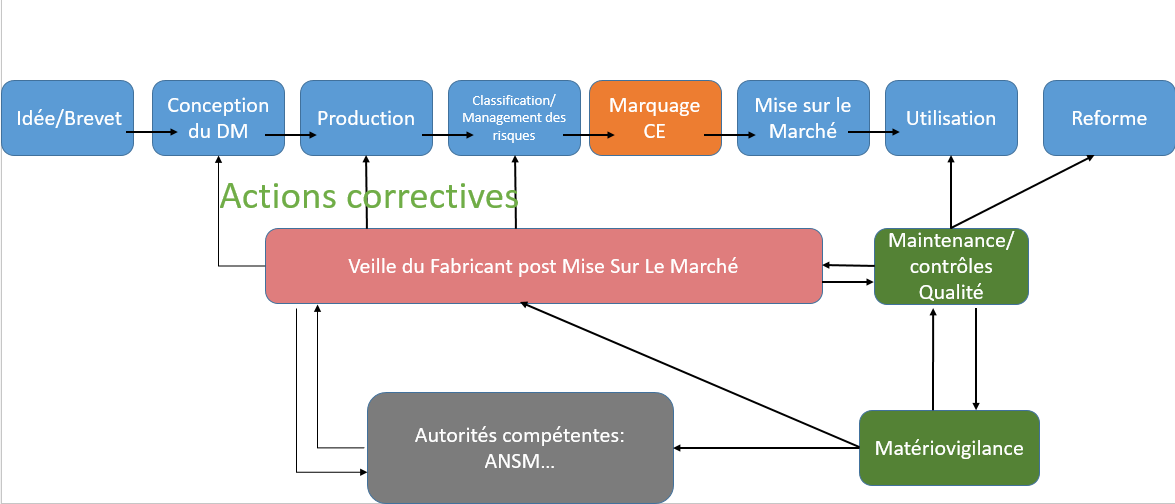
Cet article, à destination des fabricants, présente les principaux points de la directive. Texte présentant de. Pour la clarté du présent document, il est fait référence aux numéros des annexes en lieu et place des références aux arrêtés. More Advanced search.
Classification des dispositifs médicaux La Haute Autorité de Santé considère les actes de pédicurie-podologie comme étant des actes à caractère semi-critiques ou critiques. En fonction du niveau de risque, le traitement des dispositifs médicaux doit être adapté.
En application des articles L. Ces procédures permettent aux fabricants de démontrer le respect des exigences de la directive, matérialisé par le marquage CE du dispositif et la déclaration CE de conformité faite par le fabricant. Office des publications de l’Union européenne.
L’objectif de cette formation est d’identifier les étapes à mettre en œuvre pour pouvoir apposer le marquage CE sur un dispositif médical. B tive, entre un dispositif médical actif et le patient ne sont pa. La classe du dispositif médical est déterminée en fonction de l’utilisation à laquelle le fabricant destine le produit. Plus Recherche avancée.
Union Européenne Célia Chadirac To cite this version: Célia Chadirac. Sciences pharmaceutiques. La prothèse doit être livrée au chirurgien-dentiste avec une déclaration de conformité aux exigences essentielles.
Lionel Ekedi Ngando. Les gants à usage unique non destinés à un usage médical (p. ex. gants de ménage) ne sont pas des dispositifs médicaux.
Dans le cadre de ses prestations, l’équipe de NEOMED Services a récolté de nombreuses informations concernant une submersion grandissante des ON ce qui a un impact sur les délais de réponses. Il s’agit des exigences réglementaires applicables aux dispositifs médicaux incorporant comme partie intégrante une substance qui, si elle est utilisée séparément.
De plus, le nouveau règlement apporte des précisions sur les logiciels et leur classification : ils sont qualifiés de dispositifs médicaux lorsque les fabricants les destine à être utilisés pour une. Les exigences de la loi allemande sur les dispositifs médicaux (MPG) pour l‘apposition d‘un marquage sont ainsi satisfaites. Annex Vll, which apply to it. CEE qui le concement.
Dans un souci de simplification, il convient de remplacer ces deux directives, qui ont été modifiées à plusieurs reprises, par un seul et même acte législatif applicable à tous les dispositifs médicaux autres que les dispositifs médicaux de diagnostic in vitro. Le cadre de la « Nouvelle Approche » 2. Introduction au marquage CE 2. Un dispositif médical est un instrument, appareil, équipement ou encore logiciel destiné par son fabricant à être utilisé chez l’homme à des fins notamment de diagnostic, de prévention, de contrôle, de traitement, d’atténuation d’une maladie ou d’une blessure.
Ces directives précisent que cette démonstration de la conformité s’appuie sur une évaluation clinique. Il s’agit en l’occurrence de problèmes relatifs à la qualité et à l’évaluation médico-administrative des dispositifs médicaux suffisamment graves pour faire intervenir la justice : l’affaire des prothèses mammaires et celle des prothèses de hanche. Trois guides européens. Le ministre français.
Le fabricant : Ampri Handelsgesellschaft mbH Benzstr. Winsen (Luhe) Allemagne déclare sous sa propre responsabilité que.
Bonnes pratiques Obtenir du fournisseur lors d’une mise en service de lève-perso. Les pouvoirs publics ont accordé un sursis d’un an, en raison de la crise sanitaire liée au covid-1 qui a perturbé de nombreuses entreprises. L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) en.
La directive reprend les exigences en matière de conformité, de normes harmonisées, de classification des dispositifs médicaux, … sa finalité étant de garantir la performance et la sécurité des dispositifs médicaux commercialisés sur le marché Européen. Téléchargement(s) : 191.
Dispositifs médicaux. CE, le règlement (CE) n.
Commentaires
Enregistrer un commentaire