Avant le toutes les entreprises médicales devront se conformer à celle-ci. Définir la classe d’un dispositif médical(DM) est une nécessité pour tout fabricant, en Europe c ’est cette classe qui va permettre de définir les contraintes pour établir la conformité du produit aux exigences réglementaires.
Il existe quatre classes pour les DM, par ordre de criticité: I, IIa, IIb et III. Qu’est-ce qu’un dispositif médical ? Vos Masques Chirurgicaux en Stock. Disponible Immédiatement.
En Alsace, à Strasbourg. Vente de Matériel Médical. Les salariés les plus vulnérables peuvent être placés en activité partielle sur prescription médicale. Le dispositif « intra-GHS », introduit à l’article L. Liste des dispositifs médicaux compris dans le tarif afférent aux soins.
En matière de dispositifs médicaux, cette procédure s’impose à tous les acteurs du marché, c’est-à-dire à toute personne physique ou morale qui fabrique, remet à neuf, fait concevoir, fait fabriquer ou fait fabriquer un dispositif médical et le commercialise sous son nom ou sa marque. Attention : le marquage CE n’est pas une marque de certification, ni une indication de l. Nous développons des dispositifs médicaux et des services associés afin d’accompagner au mieux les patients dans leur parcours de soins.
Protection Médicale. Formulaire gratuit de création de fiche. Les modifications par rapport à la version précédente sont listées dans un encart en première page.

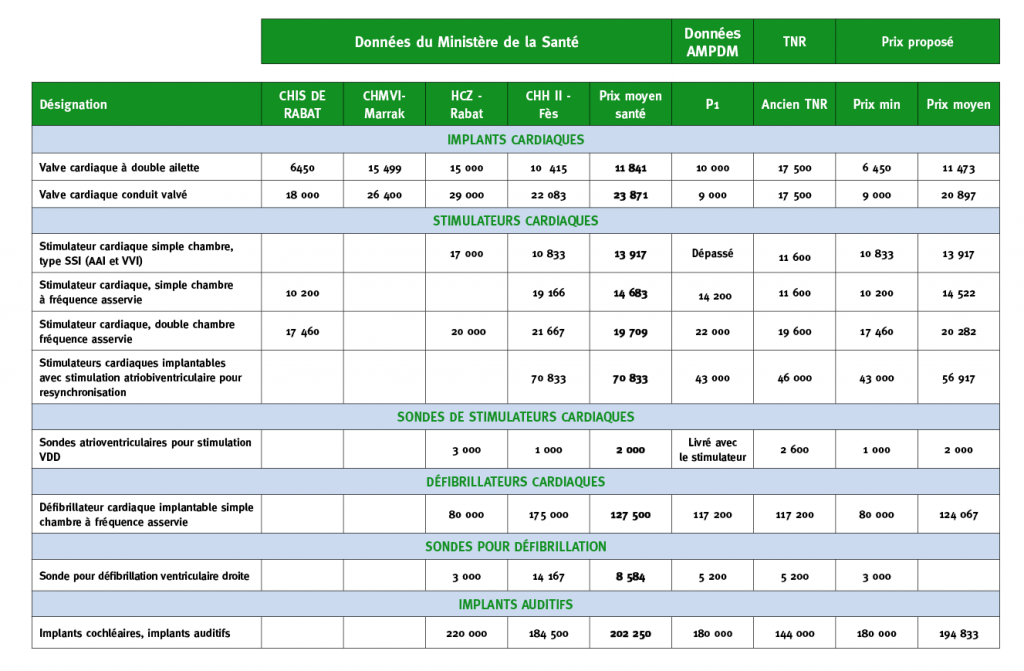
Exemples de dispositifs médicaux implantables : des prothèses de hanche, des lentilles intraoculaires, des implants mammaires. Parmi les dispositifs médicaux implantables, il existe une sous-catégorie: le dispositif médical implantable actif.
Hausse des dispositifs médicaux de la liste en sus Certains dispositifs médicaux sont également pris en charge en sus des prestations d’hospitalisation. Le ministre de la santé et des solidarités, Vu le code de la santé publique, notamment son article L. Un dispositif médical pris au hasard dans la liste : Voir la carte de dispositif médical PROSTHESIS, MANDIBULAR. Code de la Sécurité sociale.
Ce dispositif doit garantir le financement de traitements innovants et onéreux et favoriser leur accès aux patients. Les dispositifs sont regroupés sous différents fichiers selon leur mode de dispensation. Il est à la disposition de tout utilisateur (pharmacien, industriel, …).
Son utilisation et exploitation sont aujourd’hui g. Vous trouverez des fiches produits, une zone de téléchargement de catalogues, un espace bibliographie et législation, comment contacter un laboratoire. La classification des dispositifs médicaux. Le nouveau règlement relatif aux. Leur point commun ? Ils sont tous certifiés selon réglementation stricte et spécifique.

La conformité à cette réglementation est matérialisée en Europe par l’apposition du marquage CE médical. Elle peut également être utilisée tant par l’organisme en interne que par des parties externes, y compris des organismes de certification, pour les accompagner dans leurs processus d’audit. Afin de renforcer la sécurité sanitaire des dispositifs médicaux, une liste de dispositifs médicaux dite « intra-GHS » est mise en place.
Elle conditionne l’achat, la fourniture et l’utilisation de ces DM par les établissements de santé, et leur prise en charge au titre des prestations d’hospitalisation. Liste des principaux dispositifs médicaux concernés Responsabilité des acteurs Obligations et responsabilités des différents intervenants Qui peut engager votre responsabilité?
Nature de la responsabilité Gestion des risques Acquisition d’un dispositif médical Registre Sécurité,Qualité,Maintenance (RSQM) 15. L’inscription sur la liste des produits remboursables étant octroyée pour une durée maximale de ans, des données cliniques complémentaires peuvent être demandées par la CNEDIMTS en vue de la réévaluation du dispositif médical.
L’avis précise les éventuelles données cliniques spécifiques attendues que devra apporter l’industriel dans sa demande de renouvellement d. La biocompatibilité a toujours été l’un des sujets majeurs du développement des dispositifs médicaux. Nous pouvons toutefois constater des évolutions sur les méthodologies d’évaluation de dossiers techniques de nos clients par leurs Organismes Notifiés, qui placent plus que jamais le sujet de la biocompatibilité au cœur des évaluations, leur but étant de s’assurer de leur.
Commentaires
Enregistrer un commentaire